Aynı Maddenin Farklı Hallerine Örnekler
Maddenin Aşamadan Geçmesi:
Aynı Maddenin Farklı Hallerine Örnekler: Maddeye enerji eklemek fiziksel bir değişikliğe neden olarak, maddeyi bir durumdan diğerine geçirir. Örneğin, termal enerjiyi ısıtmak, onun gaz veya buhar haline gelmesine neden olur. Enerjiyi almak; suyun buz halini alması için, ısısı alınarak fiziksel değişime uğraması sağlabilmektedir. Fiziksel değişime ayrıca hareket ve basınç neden olabilmektedir.
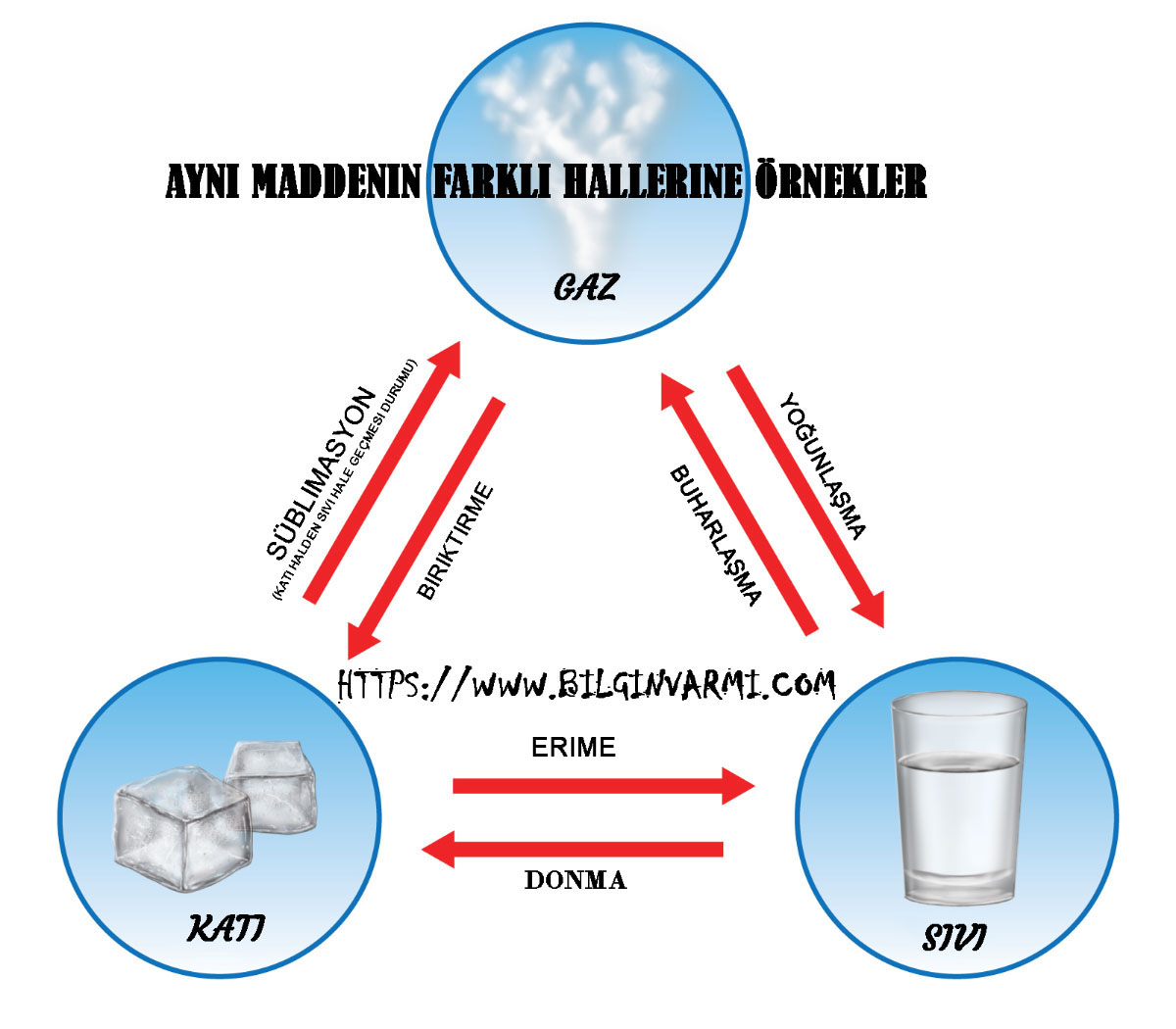
Erime ve donma:
Isı bir katıya uygulandığında, parçacıkları daha hızlı titreme gerçekleştirir ve birbirinden uzaklaşmaya başlar. Standart basınçta madde erime noktası adı verilen belirli bir noktaya ulaştığında katı sıvıya dönüşmeye başlar. Saf bir maddenin erime noktası genellikle katı ve sıvı fazların dengede olduğu nokta olan 0.1 ° C’ye kadar tespit edilebilir. Numuneye ısı vermeye devam ederseniz, sıcaklık tüm numune sıvı olana kadar erime noktasının üzerine çıkmaz. Isı enerjisi, katıyı sıvı forma dönüştürmek için kullanılmaktadır. Tüm örnek bir sıvı haline geldiğinde, sıcaklık tekrar yükselmeye başlayacaktır. Çok benzer olan bileşikler farklı erime noktalarına sahip olabilir. Örneğin, sükroz 367 F (186.1 C) erime noktasına sahipken glikozun erime noktası 294.8 F (146 C) ‘dir. Metal alaşımı gibi katı bir karışım, karışımı eriterek ve farklı erime noktalarına ulaştıklarında sıvıları çıkartarak genellikle bileşen parçalarına ayrılabilir.
Donma noktası, sıvının katı oluşturmak için yeterince soğutulduğu sıcaklıktır. Sıvı soğutulurken, parçacık hareketi yavaşlar. Birçok maddede, parçacıklar kristalin katılar oluşturması için, geometrik desenlerle hizalanmaktadır. Çoğu sıvı donarken büzülmektedir. Suyun önemli özelliklerinden biri, donunca genleşmesidir. Buz yüzmemiş olsaydı, donmuş su altında sıvı su olmazdı. Bunun yanında çok su canlısının yaşaması imkansız olurdu.
Donma noktası genellikle erime noktasıyla neredeyse aynı sıcaklıktadır. Bu durumu birkaç faktör değiştirebilmektedir, ancak bu maddenin özelliği olarak kabul edilmemelidir. Örneğin, bir sıvıya çözünmüş maddelerin ya da çözünen maddelerin eklenmesi donma noktasına etki edecektir. Bunun bir örneği, yollarımızda suyun donma sıcaklığını düşürmek için tuz kullanılmasıdır. Diğer sıvılar katılaşmaya başlamadan önce erime noktasının altındaki sıcaklıklara soğutulabilmektedir. Bu tür sıvıların “süper soğutulmuş” olduğu söylenmektedir. Aynı zamanda kristalleşme işlemini başlatmak için bir toz partikülü veya “tohum kristali” olması gerekir.
Arıtma:
Bir katı, sıvı bir fazdan geçmeden doğrudan gaza dönüştürüldüğünde, işlem “süblimasyon” olarak adlandırılmaktadır. Süblimasyon parçacıkların kinetik enerjisi, numuneyi çevreleyen atmosferik basınçtan büyük olduğunda meydana gelir. Bu, örneğin sıcaklığı kaynama noktasının ötesinde hızlı bir şekilde arttığında ortaya çıkabilir (flaş buharlaşması). Daha yaygın olarak, bir madde vakum koşulları altında soğutularak “dondurularak kurutulabilir” olabilir. Böylece madde içindeki su süblime olur ve numuneden çıkarılır. Birkaç uçucu madde normal sıcaklık ve basınçta süblime olur. Bu maddelerin en bilinenleri CO2 veya “kuru buz” dur.
Buharlaştırma:
Buharlaşma bir sıvının gaza dönüştürülmesidir. Buhar haline, kaynama yoluyla ulaşılabilmektedir.
Bir sıvının parçacıkları sürekli hareket halinde olduklarından, sıklıkla birbirleriyle çarpışırlar, böylece enerji aktarırlar. Bu enerji aktarımı, yüzeyin altında çok net bir etkiye sahip değildir, ancak yüzeye yakın bir partiküle yeterince enerji aktarıldığında; serbest gaz partikülü olarak numuneden tamamen uzaklaştırılarak yeterince enerji kazanabilmektedir. Bu işleme “buharlaşma” denir ve sıvı kaldığı sürece devam eder. Bir sıvının buharlaşırken soğuduğunu takip etmek ilginçtir. Onların uçmasına neden olan yüzey moleküllerine aktarılan enerji, kalan sıvı numuneden uzağa taşınır.
Buhar kabarcıklarının sıvının yüzeyinin altında oluşturduğu bir sıvıya yeterince ısı eklendiğinde, sıvının kaynadığını söylüyoruz. Bir sıvının kaynadığı sıcaklık değişkendir. Kaynama noktası, maddenin altındaki basınca bağlıdır. Daha yüksek basınç altındaki bir sıvı, içinde buhar kabarcıkları oluşmadan önce daha fazla ısıya ihtiyaç duyar. Yüksek irtifalarda, sıvıya daha az basınç uygulayan atmosferik basınç daha düşüktür, bu nedenle daha düşük bir sıcaklıkta kaynar. Deniz seviyesinde aynı miktarda sıvı daha yüksek bir atmosferik basınç altındadır ve daha yüksek bir sıcaklıkta kaynar.
Yoğunlaşma ve Biriktirme:
Yoğunlaşma, bir gazın sıvıya dönüşmesidir. Aynı zamanda; gaz soğutulduğunda veya parçacıkların kinetik enerjisinin moleküller arası kuvvetlerin artık üstesinden gelemediği noktaya sıkıştırıldığında meydana gelir. İlk parçacıklar kümesi, gazın daha fazla soğumasını ve böylece yoğuşmanın devam etmesini sağlayan işlemi başlatır. Gaz sıvı fazdan geçmeden, doğrudan bir katıya dönüştüğünde, biriktirme ya da yitirme olarak adlandırılmaktadır. Bunun bir örneği, düşük donma sıcaklıklarının atmosferdeki su buharını; don veya buza dönüştürdüğü zaman meydana gelir.





